Теплопроводность водных растворов солей, кислот и оснований (щелочей)
Теплопроводность водных растворов солей
В таблице представлены значения теплопроводности водных растворов солей в зависимости от концентрации при температуре 20 и 30°С.
Теплопроводность раствора выражена в Вт/(м·град). Концентрация соли в растворе от 0 (вода) до 50%.
Хорошо видно, что с повышением содержания соли в растворе его теплопроводность снижается.
В таблице представлены значения теплопроводности водных растворов следующих солей: бромид, йодид, хлорид, хлорат, перхлорат, нитрит, нитрат, сульфат, бромат, силикат, хромат, фосфат, фторид, хлорид, бромид, иодид, цианид, медный купорос, NaBr, NI, NaCh4COO, NaCl, NaClO4, NaNO2, NaNO3, NaBrO3, Na2S2O3, Na2SO4, Na2CO3 (бикарбонат натрия), Na2SiO3, Na2Cr2O7, Na3PO4, KF, KCl, KBr, KI, KC2H5COO, KNO2, KNO3, K2SO4, K2CO3, K4Fe(CN)6, MgCl2MgSO4, MgBr2, MG(NO3)2, CaCl2, Ca(NO3)2, CaBr2, BaCl2, BaBr2, BaI2, SbCl3, Sb(NO3)3, ZnSO4, ZnCl2, LiCl, LiBr, LiI, LiSO4, CuSO4, Al2(SO4)3, Nh5Cl, AgNO3, Pb(NO3)2, Co(NO3)2, Th(NO3)2.
Теплопроводность водных растворов кислот
В таблице представлены значения теплопроводности водных растворов кислот в зависимости от концентрации и температуры. Теплопроводность раствора выражена в Вт/(м·град).
Концентрация кислоты в растворах от 0 (вода) до 96% (концентрированная кислота). Теплопроводность представлена при температуре растворов от 0 до 100°С.
Теплопроводность раствора хромовой h3CrO4 и ортофосфорной h4PO4 кислот приведена только при температуре 20°С.
В таблице представлены значения теплопроводности водных растворов следующих кислот: азотной HNO3, серной h3SO4, соляной HCl, хромовой h3CrO4, ортофосфорной h4PO4.
Теплопроводность водных растворов оснований (щелочи)
В таблице представлены значения теплопроводности водных растворов щелочей в зависимости от концентрации при температуре 20 и 30°С.
Теплопроводность раствора выражена в Вт/(м·град). Концентрация щелочи в растворах от 0 (вода) до 50%.
В таблице указаны значения теплопроводности водных растворов следующих оснований (щелочи): гидроксид калия KOH, едкий натр NaOH, гидроксид аммония Nh5OH, гидроксид лития LiOH.
Источники:
- Гинзбург А. С. Теплофизические характеристики пищевых продуктов. Справочник.
- Волков. А.И., Жарский. И.М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
- Чубик И. А., Маслов А. М. Справочник по теплофизическим характеристикам пищевых продуктов и полуфабрикатов.
Сода пищевая (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия)
Производитель: Россия, Турция
Упаковка:
Мешки 25кг
Мешки 40кг
Дополнительная информация об отгрузке:
Соду пищевую (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия) транспортируют всеми видами транспорта (кроме воздушного) в крытых транспортных средствах. Допускается транспортирование двууглекислого натрия автомобильным транспортом навалом с использованием специализированного транспорта (типа муковоза) или в специально изготовленных емкостях из нержавеющей стали. Специализированные мягкие контейнеры транспортируют по железной дороге открытым подвижным составом повагонными отправками без перевалок, с погрузкой и выгрузкой на подъездных путях грузоотправителя (грузополучателя). Соду пищевую хранят в закрытых складских помещениях. Заполненные специализированные мягкие контейнеры хранят как в крытых складских помещениях, так и на открытых площадках, в 2-3 яруса по высоте.
Рекомендации:
Сода пищевая – кристаллический порошок тонкого помола, белого цвета, без запаха. Отличительной особенностью является мягкие щелочные свойства, не оказывающие вредного воздействия на животные и растительные ткани.
Температура кипения — 851° C, температура плавления — 270° C. Плотность — 2,159 г/см³.
Предназначается для химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии и розничной торговли.
Химическая формула: NaHCO3.
Технология производства :
Добывают соду сейчас промышленным аммиачным способом (способ Сольве).
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония Nh5HCO3:
Nh4 + CO2 + h3O + NaCl → NaHCO3 + Nh5Cl.
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20° C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140 — 160° C, при этом он переходит в карбонат натрия:
2NaHCO3 →(t) Na2CO3 + CO2↑ + h3O
Образовавшийся диоксид углерода и аммиак, выделенный из маточного раствора на первой стадии процесса по реакции:
2Nh5Cl + Ca(OH)2 → CaCl2 + 2Nh4↑ + 2h3O возвращают в производственный цикл.
Аммонизация раствора необходима для введения в него углекислого газа, малорастворимого в насыщенном растворе. Выпавший в виде кристаллов бикарбонат натрия отфильтровывают от раствора, содержащего хлористый аммоний и непрореагировавший NaCl, и прокаливают (кальцинируют). При этом происходит образование кальцинированной соды.
Выделяющиеся при кальцинации газы, содержащие углекислоту СO2, используют для карбонизации. Таким образом, часть затраченной углекислоты регенерируется.
Необходимую для процесса углекислоту получают обжигом известняка или мела. Обожженную известь СаО гасят водой.
Гашеная известь Са(ОН)2 замешивается с водой. Образовавшееся известковое молоко используют для регенерации аммиака из раствора (фильтровой жидкости), полученного после отделения бикарбоната и содержащего хлористый аммоний.
Для производства соды используют раствор поваренной соли (рассол) концентрации около 310 г/л, полученный в естественных условиях подземным выщелачиванием залежей поваренной соли. В естественном рассоле, помимо NaCl, обычно содержатся соли кальция и магния. При аммонизации и карбонизации рассола в результате взаимодействия этих примесей с Nh4 и СО2 будут выпадать осадки, что приведет к загрязнению аппаратов, нарушению теплообмена и нормального хода процесса. Поэтому рассол предварительно очищают от примесей: осаждают их, добавив к рассолу строго определенное количество реактивов — суспензии соды в очищенном рассоле и известкового молока. Этот способ очистки называется содово-известковым. Выпавшие при этом осадки гидрата магния и карбоната кальция отделяют в отстойниках.
Очищенный и осветленный рассол поваренной соли направляют в барботажную абсорбционную колонну. Верхняя часть колонны служит для промывки рассолом газа, отсасываемого вакуум-насосом из вакуум-фильтров, и газа из карбонизационных колонн. В этих газах содержится небольшое количество аммиака и углекислоты, которые целесообразно отмыть свежим рассолом и, таким образом, более полно использовать их в производстве. Нижняя часть колонны служит для насыщения рассола аммиаком, поступающим из дистилляционной колонны. Полученный аммиачно-соляной рассол далее направляют в барботажную карбонизационную колонну, где происходит основная реакция превращения исходного сырья в бикарбонат натрия. Необходимая для этой цели углекислота СO2 поступает из шахтной известково-обжигательной печи и печи кальцинации бикарбоната натрия и нагнетается снизу в колонну.
Карбонизация аммиачно-соляного рассола является важнейшей стадией производства соды. Образование бикарбоната натрия при карбонизации происходит в результате протекания в карбонизационной колонне сложных химических процессов. В верхней части колонны идет образование углекислого аммония из аммиака, содержащегося в рассоле, и углекислоты, подаваемой в колонну.
По мере прохождения рассола в колонне сверху вниз углекислый аммоний, реагируя с избытком углекислоты, поступающей снизу колонны, переходит в двууглекислый аммоний (бикарбонат аммония).
Примерно в середине верхней неохлаждаемой части колонны начинается реакция обменного разложения, сопровождающаяся выпадением кристаллов бикарбоната натрия и образованием в растворе хлористого аммония. В средней части колонны, где идет образование кристаллов бикарбоната натрия за счет экзотермичности реакции, температура рассола несколько повышается (до 60 — 65° C), однако охлаждать его не надо, так как такая температура способствует формированию более крупных хорошо фильтрующихся кристаллов бикарбоната натрия. Внизу колонны охлаждение необходимо для уменьшения растворимости бикарбоната натрия и увеличения его выхода. В зависимости от температуры, содержания NaCl в рассоле, степени насыщения его аммиаком и углекислотой и других факторов выход бикарбоната составляет 65-75%. Практически невозможно полное превращение поваренной соли в осадок бикарбоната натрия. В этом заключается один из существенных недостатков производства соды аммиачным методом.
Применение:
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Широко примененяется в:
— химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
— легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож).
— текстильной промышленности (отделка шелковых и хлопчатобумажных тканей). Применение бикарбоната натрия в производстве резиновых изделий также обусловлено выделением CO2 при нагревании, способствующем приданию резине необходимой пористой структуры.
— пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
— медицинской промышленности — для приготовления инъекционных растворов, противотуберкулезных препаратов и антибиотиков.
— металлургии — при осаждении редкоземельных металлов и флотации руд.
Упаковка и хранение:
Соду пищевую упаковывают в четырех-, пятислойные бумажные мешки, а также в специализированные мягкие контейнеры разового использования с полиэтиленовым вкладышем.
Гарантийный срок хранения продукта.
1 год со дня изготовления.
Качественные показатели:
Бикарбонат натрия представляет собой кристаллический порошок белого цвета со средним размером кристал лов 0,05 — 0,20 мм. Молекулярная масса соединения равна 84,01, плотность составляет 2200 кг/м³, насыпная плотность — 0,9 г/см³. Теплота растворения бикарбоната натрия исчисляется 205 кДж (48,8 ккал) на 1 кг NaHCO3, теплоемкость достигает 1,05 кДж/кг•К(0,249 ккал/кг•°С).
Гидракарбонат натрия термически малоустойчив и при нагревании разлагается с образованием твердого карбоната натрия и выделением диоксида углерода, а также воды в газовую фазу:
Сода 2NaHCO3(тв.) ↔ Na2CO3(тв.) + CO2(г.) + h3O(пар) — 126 кДж (- 30 ккал) Аналогично разлагаются и водные растворы бикарбоната натрия:
2NaHCO3(р.) ↔ Na2CO3(р.) + CO2(г.) + h3O(пар) — 20,6 кДж (- 4,9 ккал) Водный раствор бикарбоната натрия имеет слабо выраженный щелочной характер, в связи с чем на животные и растительные ткани он не действует. Растворимость гидрокарбоната натрия в воде невелика и с повышением температуры она несколько повышается: с 6,87 г на 100 г воды при 0° С до 19,17 г на 100 г воды при 80° С.
Вследствие небольшой растворимости плотность насыщенных водных растворов бикарбоната натрия сравнительно мало отличается от плотности чистой воды.
Температура кипения (разлагается): 851° C;
Температура плавления: 270° C;
Плотность: 2,159 г/см³;
Растворимость в воде, г/100 мл при 20° C: 9.
Функциональные свойства:
Химические свойства.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.
Реакция с кислотами.
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑
Сода хорошо растворяется в воде. Водный раствор питьевой соды имеет слабощелочную реакцию. Шипение соды — результат выделения углекислого газа CO2 в результате химических реакций.
Термическое разложение.
При температуре 60° C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200° C):
2NaHCO3 → Na2CO3 + h3O + CO2↑
При дальнейшем нагревании до 1000° C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
Na2CO3 → Na2O + CO2.
Физические свойства натрия: плотность, теплоемкость, теплопроводность
В таблицах представлены физические свойства натрия в зависимости от температуры в интервале от 50 до 1200 К. Указаны следующие свойства натрия: плотность, теплоемкость, температуропроводность, теплопроводность, удельное электрическое сопротивление, функция Лоренца, а также (во второй таблице) кинематическая вязкость, число Прандтля и коэффициент поверхностного натяжения.
Натрий Na представляет собой мягкий светло-серебристый металл, обладающий высокой химической активностью. Поэтому его применяют в металлургии для восстановления других металлов из руды, например, при выплавке титана из его тетрахлорида TiCl4. Натрий также применяется при производстве соды и солей, бензина, бумаги, резинотехнических изделий и в других областях промышленности.
Физические свойства натрия при повышении его температуры изменяются по-разному. Например, плотность натрия при нагревании уменьшается: при температуре 27°С плотность натрия равна 967 кг/м3, а при 1200 К она составляет уже величину 740 кг/м3. Следует отметить, что плотность натрия сравнительно низкая, она ниже плотности воды. Если положить натрий в воду, он станет плавать на ее поверхности, однако этот процесс будет непродолжительным, поскольку начнется реакция натрия с водой с выделением тепла и водорода.
Удельная теплоемкость натрия при нагревании увеличивается и может достигать значений более 1300 Дж/(кг·град). Теплоемкость натрия при комнатной температуре равна 1220 Дж/(кг·град). Теплопроводность, температуропроводность и вязкость натрия при его нагревании уменьшаются. Теплопроводность натрия равна 136 Вт/(м·град) при температуре 300 К.
Кинематическая вязкость натрия равна 6,7·10-7 м2/с при температуре 98°С, а при температуре 927°С этот металл становиться менее вязким и вязкость натрия становиться равной 2,1·10-7 м2/с. Температуропроводность натрия при комнатной температуре равна 0,000118 м2/с. Удельное электрическое сопротивление этого металла составляет величину 5·10-8 Ом·м при 300 К.
Источники:
1. В.Е. Зиновьев. Теплофизические свойства металлов при высоких температурах.
2. Чиркин В.С. Теплофизические свойства материалов ядерной техники.
Изучите физические свойства: сахара, соли, лимонной кислоты
Изучите физические свойства: а) сахара и соли, б) лимонной кислоты и соды. Результаты проведённого анализа оформите в виде таблицы.
Ответа)
| Свойства вещества | Сахар | Поваренная соль |
|---|---|---|
| Агрегатное состояние | Твердое | Твердое |
| Цвет | Бесцветное | Бесцветное |
| Запах | Без запаха | Без запаха |
| Твердость | Хрупкое | Хрупкое |
| Растворимость | Растворимое в воде | Растворимое в воде |
| Температуры плавления и кипения | tплав. = 800.8°C, tкип. = 1465°C | tплав. = 186°C |
| Плотность | 1.59 г/см³ | 1.49 г/см³ |
| Тепло- и электропроводность | Плохой проводник тепла, не проводит электрический ток | Плохой проводник тепла, не проводит электрический ток (раствор и расплав проводят электрический ток) |
б)
| Свойства вещества | Лимонная кислота | Сода пищева |
|---|---|---|
| Агрегатное состояние | Твердое | Твердое |
| Цвет | Бесцветный | Бесцветный |
| Запах | Без запаха | Без запаха |
| Твердость | Хрупкое | Хрупкое |
| Растворимость | Растворимое | Растворимое |
| Температуры плавления и кипения | tплав. = 153°C | |
| Плотность | 1.67 г/см³ | 2.16 г/см³ |
| Тепло- и электропроводность | Плохой проводник тепла, не проводит электрический ток | Плохой проводник тепла, не проводит электрический ток |
gomolog.ru1https://gomolog.ru/reshebniki/8-klass/gabrielyan-2018/3/prim-1.html
gomolog.ru11https://gomolog.ru/reshebniki/8-klass/gabrielyan-2018/3/prim-1.html
Пищевая сода – какая правильная, а какая опасная? Разбираемся с точки зрения химии.
Редкий день, когда в наш магазин не обращается очередной клиент, желающий приобрести пищевую соду, сделанную непременно по ГОСТ 2156-76. И каждый раз мы вынуждены таких людей огорчать, что ни у нас, ни у кого другого «правильную» советскую соду они уже не купят. Все российские предприятия давно перешли на производство этого химиката по стандартам, прописанным в ГОСТ 32802-2014.
Мы заинтересовались, почему некоторые люди шарахаются от соды по новому ГОСТу, как вегетарианец от стейка. И очень быстро обнаружили невероятное количество сайтов и видеороликов, посвящённых «волшебным» рецептам самолечения от профессора Неумывакина. Именно эти сетевые ресурсы и формируют массовое убеждение, что в 2016 году случилось страшное – безопасная, идеально подходящая для лечения чего угодно пищевая сода в один момент превратилась в яд, которым злобные производители травят поголовно всё население России.

Мы внимательно посмотрели несколько видеороликов, вскрывающих «страшную тайную тайну» о новом ГОСТе. Сделать это было сложно, ролики постоянно приходилось ставить на паузу, чтобы просмеяться, отдышаться и вытереть слёзы. Но мы всё же смогли довести это нелёгкое дело до конца и теперь готовы вместе с вами разобраться, что же страшного произошло с натрием двууглекислым, также известным как бикарбонат натрия или просто пищевая сода.
Зачем нужно было менять ГОСТ?
Напомним, что Россия, Казахстан, Белоруссия, Армения и Киргизия являются членам Таможенного союза и, соответственно, должны были в своё время максимально синхронизировать все документы, касающиеся безопасности товаров. Торговый оборот между этими государствами происходит по упрощённой схеме, все участники рынка должны быть уверены, что товары и продукты, поставляемые из одной страны в другую, полностью безопасны.
Одним из таких, общих для все стран Таможенного союза документов является Технический регламент Таможенного союза ТР ТС 029/2012 «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств».
Именно для того, чтобы полностью соответствовать требованиям данного регламента, ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» был заменён на ГОСТ 32802-2014 «Добавки пищевые. Натрия карбонаты Е500. Общие технические условия».
Говоря по-простому, пищевая сода по старому ГОСТу не могла экспортироваться в страны Таможенного союза как пищевая добавка. Как хорошо известно, пищевая промышленность является одним из основных потребителей соды и терять этот рынок не было никакого резона.
Новый ГОСТ вступил в силу 1 января 2016 года и в технологии производства пищевой соды… ничего не изменилось! То есть, вообще ничего! Как делали её заводы, так и делают. Ровно то же химическое вещество, ровно с теми же физико-химическими свойствам. Только бумаги сопроводительные обновили и всем регламентам теперь соответствуют.
Загадочное переименование
Особое веселье у химиков вызывают рассуждения всевозможных «экспертов» от народа, которые, сохраняя на лице полную невозмутимость, вещают, что производители пищевой соды сами себя разоблачают «в преступлениях против человека». Ведь не зря же раньше на упаковке соды было написано «Натрий двууглекислый», а теперь «Гидрокарбонат натрия. Е500».
Получается, мало того, что вместо правильного и полезного двууглекислого натрия в коробочку на надписью «Сода пищевая» нынче насыпают явно вредный и возможно ядовитый гидрокарбонат натрия, так ещё и не стесняются сообщить всем, что это пищевая добавка Е500! Хотя каждый знает, что все «е-шки» – это ГМО и канцерогены! В общем, караул!
Если же говорить серьёзно, то ещё в 7-8 классах общеобразовательных школ, на уроках химии всем без исключения детям объясняют, что одно и то же химическое вещество может называться совершенно по-разному.
Так исторически сложилось, в одной стране – одна классификация веществ, в другой – свои правила наименования. Веками учёные переезжали из одной страны в другую, что-то привносили с собой, что-то перенимали на месте. Плюс добавлялись разные народные названия химикатов.
Вот есть вещество серебро азотнокислое. Оно же – нитрат серебра. Оно же – ляпис и чёртов палец.
А вот есть натрий гидроокись. Он же – едкий натр. Он же – гидроксид натрия. Он же – каустическая сода. Он же – едкая щёлочь и ещё штук пять более редких названий.
Медь сернокислую можно называть сульфатом меди. А вы её знаете, как медный купорос.
И так далее, примеров можно привести тысячи.
Поэтому и в переименовании натрия двууглекислого в гидрокарбонат натрия ничего тайного и опасного нет. Просто новый ГОСТ касается всех карбонатов натрия, а не только гидрокарбоната, который можно было бы по-прежнему называть двууглекислым натрием. А так – как было вещество с формулой NaHCO3, так и осталось. Кстати, пищевую соду ещё можно назвать натрий углекислый кислый или сода двууглекислая.
Что касается Е500 – то давайте про ужасные пищевые добавки в другой раз. А пока вот вам такая картинка.

Битва двух ГОСТов – так ядовита или нет “новая” пищевая сода?
Ну и, наконец, давайте трезво посмотрим, что же изменилось в ГОСТе на соду в 2014 году.
Вот ссылка на ГОСТ 2156-76 – http://docs.cntd.ru/document/1200019010
А вот ГОСТ 32802-2014 – http://docs.cntd.ru/document/1200112019
Возьмём основные показатели продукции для ГОСТа 1976 года.
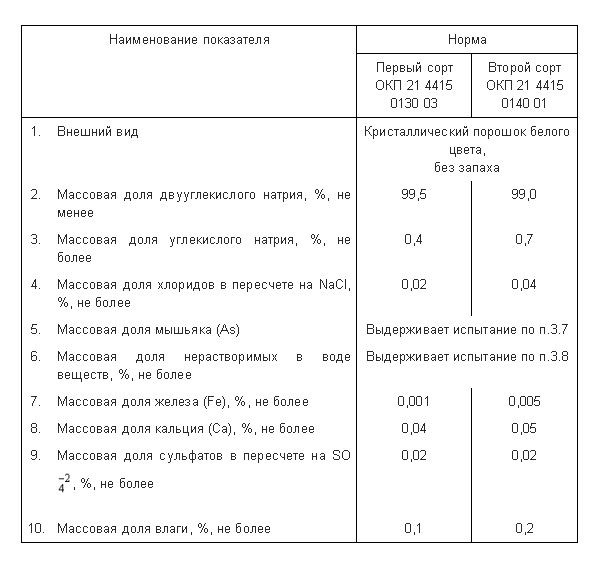
Как видно, «советская» сода первого сорта должна была содержать не менее 99,5% натрия двууглекислого, не более 0,4% натрия углекислого и не более 0,02% поваренной соли (NaCl). Остальные сотые доли процентов приходились на примеси железа, кальция, сульфатов и воду.
Что же изменилось в стандартах производства пищевой соды 1 января 2016 года?
Прежде всего, новый ГОСТ описывает требования не только к пищевой соде, но и к её «соседям» – карбонату натрия (он же – кальцинированная сода) и натрию сесквикарбонату (смеси карбона натрия и гидрокарбоната натрия, который, как мы уже хорошо помним, по-другому называется натрий двууглекислый. ).
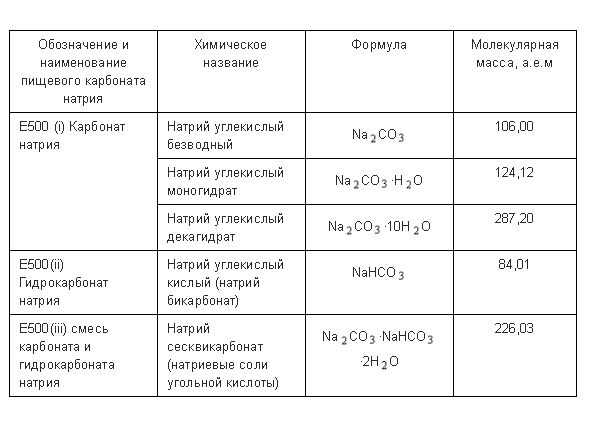

Сосредоточим внимание на гидрокарбонате натрия Е500 (ii). По новому стандарту, содержание натрия двууглекислого в пищевой соде не может быть ниже 99,0%.
«Ага! Вот и попались жулики!», – скажут нам довольные любители раскрывать всякие заговоры Раньше-то натрия двууглекислого было 99,5%, а теперь только 99,0% Исчезнувшие 0,5% – это явно добавленные загрязнения, а то и отрава какая!
Не будем спешить и почитаем ГОСТ дальше. Во-первых, не меньше – это не значит ровно. Это значит, что допускается и больше. Например, в пищевой соде, которая продаётся в нашей компании, содержание натрия двууглекислого – 99,8%.
Стоп! То есть, мы продаём соду, которая чище, чем по знаменитому ГОСТ 2156-76? Да, и это нормально. Повторим ещё раз: ГОСТом определяются пороговые (минимальные или максимальные) значения, а в реальности показатели могут отличаться.
Хорошо, идём дальше. Видим, что теперь пищевая сода может содержать чуть больше влаги (не 0,1%, а до 0,25% – подчеркнём, речь идет о десятых долях процента) и появились требования к pH раствора соды.
Те самые недостающие 0,5% (которые на практике заметно меньше) – это карбонат натрия и вода.
Что касается содержание токсичных элементов (мышьяк, свинец, ртуть) в пищевых карбонатах натрия, то оно не должно превышать норм, установленных нормативными правовыми актами, действующими на территории государства, принявшего стандарт. Можно не сомневаться, что во всех странах ограничения на содержание таких веществ максимально строгие.
Напрашивающееся резюме
За 40 лет, прошедших с момента вступления в силу ГОСТа 2156-76, многое изменилось. Распался СССР, химические заводы неоднократно сменили собственников и обновили оборудование, возник Таможенный союз…
Новые времена диктуют новые правила, которым должна соответствовать любая продукция в нашей стране. Поменялись (весьма незначительно) требования и к такой привычной и знакомой всем пищевой соде, которая годами тихо-мирно стояла в дальнем углу шкафчика на каждой кухне и никого особо не волновала.
И только благодаря «открытиям» профессора Неумывакина внимание людей к наименованию и ГОСТу соды пищевой стало сверхпристальным.
С точки зрения химии не изменилось ничего. С точки зрения раскрывателей заговоров – покупать соду теперь можно только за рубежом, например, в США, где она особенная и экологичная, пусть и стоит в 10 раз дороже. Ссылочка с кодом, по которому разоблачитель получит процент с продажи – обязательно прилагается.
Итак, если пищевая сода нужна вам для бытовых или кулинарных целей – смело покупайте её в ближайшем супермаркете. Она везде одинаковая!!!
Если же вы собрались доверить свою жизнь и здоровье советам из интернета, можем лишь ещё раз настойчиво порекомендовать не делать этого!
Не занимайтесь самолечением, не доверяйте слепо историям чудесного исцеления! В природе не существует веществ, которые одновременно могут лечить десятки различных заболеваний!
Приобретайте лекарственные вещества только в аптеках и принимайте их только по назначению врача!
Вода и уксусная кислота: сходства и различия
Со школьной скамьи мы помним задания на уроках химии — сравнить свойства разных веществ: кристаллов, жидкостей и т.д. Сегодня мы совершим путешествие во времени. Вернемся назад в школу и проведем сравнительный анализ обыкновенной воды и уксусной кислоты. С этими жидкостями мы сталкиваемся не так уж и редко. Особенно с водой. Что касается уксуса, то в хозяйстве всегда должна быть бутылка этого вещества. Попробуем сравнить их…
Для начала уточним терминологию
Как мы знаем из курса химии, характеристики того или иного вещества зависят не только от химического состава. Большую роль играют концентрация элементов и наличие примесей. Например, уксусная кислота неоднородна по составу: бывает столовый уксус 3,6 и 9%, уксусная эссенция и т.д. Эти вещества хоть и относятся к одному химическому классу, но имеют существенные различия.
Рассмотрим подробнее:
- Уксусная кислота — это продукт окисления этилового спирта или же перегонки биологического сырья. К такому сырью относят переспелые фрукты, забродившие соки и вина. 100% уксус относится к категории слабых кислот, хорошо смешивается с водой, спиртом, бензолом и эфиром. При смешивании с Н2О получают уксусную эссенцию с концентрацией 70-80%.
- Столовый уксус — этот незаменимый в кулинарии и быту продукт получают разбавлением уксусной эссенции. Если исходное вещество имеет концентрацию 70-80%, то столовый уксус, обильно заправленный водой — всего 3, 6 или 9%. Получить из эссенции столовый уксус несложно. Достаточно правильно рассчитать объемы жидкостей.
Мы определили, что уксус имеет различную концентрацию, которая и определяет свойства, назначение и название раствора. Приступим к сравнению воды и уксусной кислоты.
Что важно при сравнительном анализе жидкостей?
В лаборатории, как правило, изучают физические и химические показатели веществ.
В первом случае определяют:
- Оптические характеристики — мутность/прозрачность, поглощение световых лучей.
- Вкус, запах.
- Температуру газообразование или плавления.
- Теплопроводность и теплоемкость.
- Плотность.
- Электропроводимость и другие свойства.
Химические показатели — это способность вещества вступать в реакции с другими химическими соединениями.
Итак, вода и уксусная кислота — прозрачные субстанции, которые при небольших объемах не имеют цвета. Температура кипения воды и уксуса примерно равные: вода — 100 градусов, а уксусная кислота — 118 градусов Цельсия. Уксус несколько плотнее воды, примерно на 1,05 кг/м3.
Физические отличия воды и уксуса:
- Чистая вода не обладает вкусом и запахом, тогда как уксусная кислота имеет характерный кисловатый привкус и резкий запах.
- Поверхностное натяжение воды выше в 3 раза и составляет 72,86 мН/м против 27,8 мН/м уксуса.
- При охлаждении вода превращается в кристаллы, а уксус в льдистую массу.
- Теплоемкость воды также выше в 2 раза — 4,1 Дж/г·K против 2,01 Дж/г·K уксуса.
Кроме того, различия уксуса и воды вызваны и химическими свойствами. В частности кислота имеет куда более сложную формулу — Ch4COOH и представляет собой органическое вещество. Вода же — это неорганика и её формула проста — Н2О.
Общие химические показатели:
- Вода и уксус взаимодействуют с активными металлами — натрием, кальцием, калием и другими. Результат реакции — водород.
- Взаимодействуют с хлором и щелочными оксидами.
Отличительные характеристики:
- Вода имеет рН около 7, тогда как уксус — это кислота с рН равным 3.
- Вода — растворитель, тогда как уксус — окислитель.
- Н2О реагирует с солями слабых кислот — гидролиз, а уксус нет.
- Вода разлагается на молекулярные составляющие под воздействием электротока и высоких температур. Подобная реакция для уксусной кислоты потребует больших затрат энергии и наличие вещества-катализатора.
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
Химическая формула соды: пищевой, питьевой, кристаллической, технической
Словом «сода» называют несколько сложных химических веществ. Пищевая, питьевая, гидрокарбонат натрия, химическая формула NaHCO3, кислая натриевая соль угольной кислоты. Кальцинированная, бельевая, карбонат натрия, химическая формула Na2CO3, натриевая соль угольной кислоты.
Каустическая, гидроксид натрия, химическая формула NaOH. Есть еще некоторые технические виды соды – кристаллогидраты, содержащие карбонат натрия, и различные марки каустика. Вышеперечисленные соединения имеют различные свойства и химические формулы. Но все они хорошо растворяются в воде, а их растворы имеют более или менее выраженную щелочную реакцию. Рассмотрим их подробнее.
Формула пищевой соды
Гидрокарбонат натрия – химическое название белого кристаллического порошка белого цвета со средним размером кристаллов 0,05 — 0,20 мм. Синонимы, часто встречающиеся в научно-популярной литературе и в быту, — пищевая сода, чайная, питьевая, натрий двууглекислый, бикарбонат натрия.
Двууглекислый натрий (бикарбонат) – широко востребованное вещество в разных сферах жизни. Он применяется в химической промышленности и медицине, в легкой, пищевой отраслях, в металлургии. В пищевой промышленности сода включена в состав добавки E500.
Формула питьевой соды в химии NaHCO3 говорит о том, что это кислая натриевая соль угольной кислоты. Ее химические свойства как у соли сильного основания и слабой кислоты.

Гидрокарбонат натрия активно вступает в реакцию с кислотами. В результате образуется соль соответствующей кислоты, угольная кислота, которая в свою очередь распадается на углекислый газ и воду. Сильное образование пузырьков — это углекислый газ, высвобождающийся в процессе реакции.
Вот как происходит реакция с соляной кислотой:
NaHCO3 + HCl → NaCl + h3CO3
h3CO3 → h3O + CO2↑.
Реакция соды пищевой с уксусной кислотой:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
В результате взаимодействия соды NaHCO3 с уксусной кислотой Ch4COOH образуются: Ch4COONa – ацетат натрия, вода h3O и углекислый газ CO2.
Многими, наверное, замечено, что если залить пищевую соду кипятком, она так же начинает гаситься, что выражается в обильном образовании пузырьков. Это происходит реакция термического разложения.
Гидракарбонат натрия термически малоустойчив. При нагревании порошок соды пищевой разлагается с образованием карбоната натрия (соды кальцинированной) и выделением диоксида углерода, а также воды в газовую фазу.
2NaHCO3↔ Na2CO3 + CO2 + h3O
Аналогично разлагаются и водные растворы бикарбоната натрия.
Растворяется ли пищевая сода в воде?
Есть 2 важные момента в растворении натрия гидрокарбоната в воде. Если мы растворяем соду притемпературе до 50 °С, происходит реакция гидролиза соли. Это обратимое взаимодействие соли с водой. Приводит к образованию слабого электролита.
А если растворяем соду в горячей воде, то уже образуется карбонат натрия, и в этом случае, водный раствор имеет сильнощелочную реакцию. Отсюда вывод: растворимость гидрокарбоната натрия в воде невелика, но при повышении температуры и она повышается.

При взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия NaOH , который придает щелочность воде, угольную кислоту h3CO3, которая, в свою очередь, сразу же распадается на воду и углекислый газ h3O + CO2.
Химическая формула растворения соды в воде:
NaHCO3 + h3O ↔ h3CO3 (h3O + CO2) + NaOH
Водный раствор соды пищевой на растительные и животные ткани практически не действует.
Кальцинированная сода и ее кристаллогидраты
Карбонат натрия, или соду кальцинированную, натриевая соль угольной кислоты, не следует путать с содой пищевой. Химическая формула соды кальцинированной Na2CO3. Еще ее называют содой бельевой, потому что применяют в изготовлении моющих и чистящих средств бытовой химии. Добывается из природных кристаллогидратов путем термического разложения. Кальцинированная сода, безводный карбонат натрия, представляет собой бесцветный порошок.

Различные кристаллогидраты кальцинированной соды имеют свои названия:
- Натрит, натрон – декагидрат карбоната натрия. Химическая формула: Na2CO3 • 10h3O
- Термонатрит – моногидрат карбоната натрия. Химическая формула: Na2CO3 • h3O
Эти кристаллогидраты еще называют кристаллической содой, технической содой.
Каустическая сода, гидроксид натрия, химическая формула: NaOH. Ее еще называют едким натром, каустиком, едкой щелочью. Сильное основание, молекулы полностью диссоциируют в воде. Даже на воздухе то вещество начинает активно впитывать воду и «расплывается».
Опасная едкая щелочь может оставлять на коже сильные ожоги. Поэтому при работе с каустической содой необходимо соблюдать технику безопасности.

Применяется в быту, в химической, целлюлозно-бумажной промышленности, для производства мыла и био-дизельного топлива.
В России производится несколько видов технической соды – натра едкого:
- РД — раствор диафрагменный, бесцветная или окрашенная жидкость с массовой долей NaOH 44,0 % — 46,0 %;
- РХ — раствор химический с массовой долей NaOH 45,5 %, допускается небольшой осадок;
- РР — раствор ртутный, прозрачная жидкость с массовой долей NaOH 42,0 %;
- ТД — твердый диафрагменный, плавленая масса белого цвета с массовой долей NaOH 94,0 %;
- ТР — твёрдый ртутный, чешуированная масса белого цвета, с массовой долей NaOH 98,5 %.
Как видите, сода соде рознь. Принимать внутрь можно только пищевую, остальные виды — технические. Особенно осторожно необходимо обращаться с каустической содой. Это едкое агрессивное вещество оставляет долго незаживающие ожоги на коже. Поэтому, работать с растворами каустика нужно в защитной одежде, маске и резиновых перчатках.
Теплопроводность выбранных материалов и газов
Теплопроводность — это свойство материала, которое описывает способность проводить тепло. Теплопроводность может быть определена как
«количество тепла, передаваемого через единицу толщины материала в направлении, нормальном к поверхности единицы площади, за счет градиента единичной температуры в условиях устойчивого состояния»
Теплопроводность единицами являются [Вт / (м · К)] в системе СИ и [БТЕ / (час фут ° F)] в британской системе мер.
См. Также изменения теплопроводности в зависимости от температуры и давления , для: воздуха, аммиака, двуокиси углерода и воды
Теплопроводность для обычных материалов и продуктов:
| Теплопроводность — k — Вт / (м · К) | ||||||
|---|---|---|---|---|---|---|
| Материал / вещество | Температура | |||||
| 25 o C (77 o F) | 125 o C (257 o F) | 225 o C (437 o F) | ||||
| Acetals | 0.23 | |||||
| Ацетон | 0,16 | |||||
| Ацетилен (газ) | 0,018 | |||||
| Акрил | 0,2 | |||||
| Воздух, атмосфера (газ) | 0,0262 | 0,0333 | 0,0398 | |||
| Воздух, высота над уровнем моря 10000 м | 0,020 | |||||
| Агат | 10,9 | |||||
| Спирт | 0.17 | |||||
| Глинозем | 36 | 26 | ||||
| Алюминий | ||||||
| Алюминий Латунь | 121 | |||||
| Оксид алюминия | 30 | |||||
| Аммиак (газ) | 0,0249 | 0,0369 | 0,0528 | |||
| Сурьма | 18,5 | |||||
| Яблоко (85.6% влаги) | 0,39 | |||||
| Аргон (газ) | 0,016 | |||||
| Асбестоцементная плита | 0,744 | |||||
| Асбестоцементные листы | 0,166 | |||||
| Асбестоцемент | 2,07 | |||||
| Асбест неплотно упакованный | 0,15 | |||||
| Асбестовый картон | 0.14 | |||||
| Асфальт | 0,75 | |||||
| Бальзовое дерево | 0,048 | |||||
| Битум | 0,17 | |||||
| Слои битума / войлока | 0,5 | |||||
| Говядина постная (влажность 78,9%) | 0,43 — 0,48 | |||||
| Бензол | 0,16 | |||||
| Бериллий | ||||||
| Висмут | 8.1 | |||||
| Битум | 0,17 | |||||
| Доменный газ (газ) | 0,02 | |||||
| Весы котла | 1,2 — 3,5 | |||||
| Бор | 25 | |||||
| Латунь | ||||||
| Бриз | 0,10 — 0,20 | |||||
| Кирпич плотный | 1.31 | |||||
| Кирпич огнеупорный | 0,47 | |||||
| Кирпич изоляционный | 0,15 | |||||
| Кирпичная кладка обыкновенная (строительный кирпич) | 0,6 -1,0 | |||||
| Кирпичная кладка , плотная | 1,6 | |||||
| Бром (газ) | 0,004 | |||||
| Бронза | ||||||
| Коричневая железная руда | 0.58 | |||||
| Масло (влажность 15%) | 0,20 | |||||
| Кадмий | ||||||
| Силикат кальция | 0,05 | |||||
| Углерод | 1,7 | |||||
| Двуокись углерода (газ) | 0,0146 | |||||
| Окись углерода | 0,0232 | |||||
| Чугун | ||||||
| Целлюлоза, хлопок, древесная масса и регенерированная | 0.23 | |||||
Ацетат целлюлозы, формованный, лист | 0,17 — 0,33 | |||||
| Нитрат целлюлозы, целлулоид | 0,12 — 0,21 | |||||
| Цемент, Портленд | 0,29 | |||||
| Цемент, строительный раствор | 1,73 | |||||
| Керамические материалы | ||||||
| Мел | 0.09 | |||||
| Древесный уголь | 0,084 | |||||
| Хлорированный полиэфир | 0,13 | |||||
| Хлор (газ) | 0,0081 | |||||
| Хром никелевая сталь | 16,3 | |||||
| Хром | ||||||
| Оксид хрома | 0,42 | |||||
| Глина, от сухой до влажной | 0.15 — 1,8 | |||||
| Глина насыщенная | 0,6 — 2,5 | |||||
| Уголь | 0,2 | |||||
| Кобальт | ||||||
| Треск (влажность 83% содержание) | 0,54 | |||||
| Кокс | 0,184 | |||||
| Бетон, легкий | 0,1 — 0,3 | |||||
| Бетон, средний | 0.4 — 0,7 | |||||
| Бетон, плотный | 1,0 — 1,8 | |||||
| Бетон, камень | 1,7 | |||||
| Константан | 23,3 | |||||
| Медь | ||||||
| Кориан (керамический наполнитель) | 1,06 | |||||
| Пробковая плита | 0,043 | |||||
| Пробка, повторно гранулированная | 0.044 | |||||
| Пробка | 0,07 | |||||
| Хлопок | 0,04 | |||||
| Вата | 0,029 | |||||
| Углеродистая сталь | ||||||
| Утеплитель из шерсти | 0,029 | |||||
| Купроникель 30% | 30 | |||||
| Алмаз | 1000 | |||||
| Диатомовая земля (Sil-o-cel) | 0.06 | |||||
| Диатомит | 0,12 | |||||
| Дуралий | ||||||
| Земля, сухая | 1,5 | |||||
| Эбонит | 0,17 | |||||
| 11,6 | ||||||
| Моторное масло | 0,15 | |||||
| Этан (газ) | 0.018 | |||||
| Эфир | 0,14 | |||||
| Этилен (газ) | 0,017 | |||||
| Эпоксидный | 0,35 | |||||
| Этиленгликоль | 0,25 | Перья | 0,034 | |||
| Войлок | 0,04 | |||||
| Стекловолокно | 0.04 | |||||
| Волокнистая изоляционная плита | 0,048 | |||||
| Древесноволокнистая плита | 0,2 | |||||
| Огнеупорный кирпич 500 o C | 1,4 | |||||
| Фтор (газ) | 0,0254 | |||||
| Пеностекло | 0,045 | |||||
| Дихлордифторметан R-12 (газ) | 0.007 | |||||
| Дихлордифторметан R-12 (жидкость) | 0,09 | |||||
| Бензин | 0,15 | |||||
| Стекло | 1,05 | |||||
| Стекло, Жемчуг, жемчуг | 0,18 | |||||
| Стекло, жемчуг, насыщенное | 0,76 | |||||
| Стекло, окно | 0.96 | |||||
| Стекло-вата Изоляция | 0,04 | |||||
| Глицерин | 0,28 | |||||
| Золото | ||||||
| Гранит | 1,7 — 4,0 | |||||
| Графит | 168 | |||||
| Гравий | 0,7 | |||||
| Земля или почва, очень влажная зона | 1.4 | |||||
| Земля или почва, влажная зона | 1,0 | |||||
| Земля или почва, сухая зона | 0,5 | |||||
| Земля или почва, очень сухая зона | 0,33 | |||||
| Гипсокартон | 0,17 | |||||
| Волос | 0,05 | |||||
| ДВП высокой плотности | 0.15 | |||||
| Лиственные породы (дуб, клен …) | 0,16 | |||||
| Hastelloy C | 12 | |||||
| Гелий (газ) | 0,142 | |||||
| Мед ( 12,6% влажности) | 0,5 | |||||
| Соляная кислота (газ) | 0,013 | |||||
| Водород (газ) | 0,168 | |||||
| Сероводород (газ) | 0.013 | |||||
| Лед (0 o C, 32 o F) | 2,18 | |||||
| Инконель | 15 | |||||
| Чугун | 47-58 | |||||
| Изоляционные материалы | 0,035 — 0,16 | |||||
| Йод | 0,44 | |||||
| Иридий | 147 | |||||
| Железо | ||||||
| Оксид железа | 0 .58 | |||||
| Капок изоляция | 0,034 | |||||
| Керосин | 0,15 | |||||
| Криптон (газ) | 0,0088 | |||||
| Свинец | ||||||
| , сухой | 0,14 | |||||
| Известняк | 1,26 — 1,33 | |||||
| Литий | ||||||
| Магнезиальная изоляция (85%) | 0.07 | |||||
| Магнезит | 4,15 | |||||
| Магний | ||||||
| Магниевый сплав | 70-145 | |||||
| Мрамор | 2,08 — 2,94 | |||||
| Ртуть, жидкость | ||||||
| Метан (газ) | 0,030 | |||||
| Метанол | 0.21 | |||||
| Слюда | 0,71 | |||||
| Молоко | 0,53 | |||||
| Изоляционные материалы из минеральной ваты, шерстяные одеяла .. | 0,04 | |||||
| Молибден | ||||||
| Монель | ||||||
| Неон (газ) | 0,046 | |||||
| Неопрен | 0.05 | |||||
| Никель | ||||||
| Оксид азота (газ) | 0,0238 | |||||
| Азот (газ) | 0,024 | |||||
| Закись азота (газ) | 0,0151 | |||||
| Нейлон 6, Нейлон 6/6 | 0,25 | |||||
| Масло машинное смазочное SAE 50 | 0,15 | |||||
| Оливковое масло | 0.17 | |||||
| Кислород (газ) | 0,024 | |||||
| Палладий | 70,9 | |||||
| Бумага | 0,05 | |||||
| Парафиновый воск | 0,25 | Торф | 0,08 | |||
| Перлит, атмосферное давление | 0,031 | |||||
| Перлит, вакуум | 0.00137 | |||||
| Фенольные литые смолы | 0,15 | |||||
| Формовочные смеси фенолформальдегид | 0,13 — 0,25 | |||||
| Фосфорбронза | 110 | Pinchbe20 159 | ||||
| Шаг | 0,13 | |||||
| Карьерный уголь | 0.24 | |||||
| Штукатурка светлая | 0,2 | |||||
| Штукатурка, металлическая планка | 0,47 | |||||
| Штукатурка песочная | 0,71 | |||||
| Штукатурка, деревянная планка | 0,28 | |||||
| Пластилин | 0,65 — 0,8 | |||||
| Пластмассы вспененные (изоляционные материалы) | 0.03 | |||||
| Платина | ||||||
| Плутоний | ||||||
| Фанера | 0,13 | |||||
| Поликарбонат | 0,19 | |||||
| Полиэстер | ||||||
| Полиэтилен низкой плотности, PEL | 0,33 | |||||
| Полиэтилен высокой плотности, PEH | 0.42 — 0,51 | |||||
| Полиизопреновый каучук | 0,13 | |||||
| Полиизопреновый каучук | 0,16 | |||||
| Полиметилметакрилат | 0,17 — 0,25 | Полипропилен | 0,1 — 0,22||||
| Полистирол вспененный | 0,03 | |||||
| Полистирол | 0.043 | |||||
| Пенополиуретан | 0,03 | |||||
| Фарфор | 1,5 | |||||
| Калий | 1 | |||||
| Картофель, сырая мякоть | 0,55 | |||||
| Пропан (газ) | 0,015 | |||||
| Политетрафторэтилен (ПТФЭ) | 0,25 | |||||
| Поливинилхлорид, ПВХ | 0.19 | |||||
| Стекло Pyrex | 1,005 | |||||
| Кварц минеральный | 3 | |||||
| Радон (газ) | 0,0033 | |||||
| Красный металл | ||||||
| Рений | ||||||
| Родий | ||||||
| Порода, твердая | 2-7 | |||||
| Порода, вулканическая порода (туф) | 0.5 — 2,5 | |||||
| Изоляция из каменной ваты | 0,045 | |||||
| Канифоль | 0,32 | |||||
| Резина, ячеистая | 0,045 | |||||
| Резина натуральная | 0,13 | |||||
| Рубидий | ||||||
| Лосось (влажность 73%) | 0,50 | |||||
| Песок сухой | 0.15 — 0,25 | |||||
| Песок влажный | 0,25 — 2 | |||||
| Песок насыщенный | 2-4 | |||||
| Песчаник | 1,7 | |||||
| Опилки | 0,08 | |||||
| Селен | ||||||
| Овечья шерсть | 0,039 | |||||
| Аэрогель кремнезема | 0.02 | |||||
| Кремниевая литая смола | 0,15 — 0,32 | |||||
| Карбид кремния | 120 | |||||
| Кремниевое масло | 0,1 | |||||
| Серебро | ||||||
| Шлаковая вата | 0,042 | |||||
| Сланец | 2,01 | |||||
| Снег (температура <0 o C) | 0.05 — 0,25 | |||||
| Натрий | ||||||
| Хвойные породы (пихта, сосна ..) | 0,12 | |||||
| Почва, глина | 1,1 | |||||
| Почва, с органическими материя | 0,15 — 2 | |||||
| Грунт насыщенный | 0,6 — 4 | |||||
Припой 50-50 | 50 | |||||
Сажа | 0.07 | |||||
Насыщенный пар | 0,0184 | |||||
| Пар низкого давления | 0,0188 | |||||
| Стеатит | 2 | |||||
| Сталь углеродистая | ||||||
| Сталь, нержавеющая | ||||||
| Изоляция из соломенных плит, сжатая | 0,09 | |||||
| Пенополистирол | 0.033 | |||||
| Диоксид серы (газ) | 0,0086 | |||||
| Сера кристаллическая | 0,2 | |||||
| Сахара | 0,087 — 0,22 | |||||
| Тантал | ||||||
| Смола | 0,19 | |||||
| Теллур | 4,9 | |||||
| Торий | ||||||
| Древесина, ольха | 0.17 | |||||
| Древесина, ясень | 0,16 | |||||
| Древесина, береза | 0,14 | |||||
| Лес, лиственница | 0,12 | |||||
| Древесина, клен | 0,16 | |||||
| Древесина дубовая | 0,17 | |||||
| Древесина осина | 0,14 | |||||
| Древесина оспа | 0.19 | |||||
| Древесина, бук красный | 0,14 | |||||
| Древесина, сосна красная | 0,15 | |||||
| Древесина, сосна белая | 0,15 | |||||
| Древесина ореха | 0,15 | |||||
| Олово | ||||||
| Титан | ||||||
| Вольфрам | ||||||
| Уран | ||||||
| Пенополиуретан | 0.021 | |||||
| Вакуум | 0 | |||||
| Гранулы вермикулита | 0,065 | |||||
| Виниловый эфир | 0,25 | 0,606 | ||||
| Вода, пар (пар) | 0,0267 | 0,0359 | ||||
| Пшеничная мука | 0.45 | |||||
| Белый металл | 35-70 | |||||
| Древесина поперек волокон, белая сосна | 0,12 | |||||
| Древесина поперек волокон, бальза | 0,055 | |||||
| Древесина поперек волокон, сосна желтая, древесина | 0,147 | |||||
| Дерево, дуб | 0,17 | |||||
| Шерсть, войлок | 0.07 | |||||
| Древесная вата, плита | 0,1 — 0,15 | |||||
| Ксенон (газ) | 0,0051 | |||||
| Цинк | ||||||
Пример — Проводящая теплопередача через Алюминиевый горшок и горшок из нержавеющей стали

Кондуктивная теплопередача через стенку горшка может быть рассчитана как
q = (к / с) A dT (1)
или
q / A = (к / с) dT
где
q = теплопередача (Вт, БТЕ / ч)
A = площадь поверхности (м 2 , фут 2 )
q / A = теплопередача на единицу площади (Вт / м 2 , Btu / (h ft 2 ))
k = среднеквадратичная проводимость (Вт / мК, БТЕ / (час фут · ° F) )
dT = t 1 — t 2 = разница температур ( o C, o F)
s = толщина стенки (м, фут)
Калькулятор теплопроводности
k = теплопроводность (Вт / мК, БТЕ / (час фут ° F) )
s = толщина стенки (м, фут)
A = площадь поверхности (м 2 , фут 2 )
dT = t 1 — t 2 = разница температур ( o C, или F)
Примечание! — общая теплопередача через поверхность определяется « общим коэффициентом теплопередачи », который в дополнение к кондуктивной теплопередаче зависит от
Кондуктивная теплопередача через алюминиевую стенку горшка толщиной 2 мм — разность температур 80 o C
Теплопроводность алюминия составляет 215 Вт / (м · K) (из таблицы выше).Кондуктивная теплопередача на единицу площади может быть рассчитана как
q / A = [(215 Вт / (м · K)) / (2 10 -3 м)] (80 o C)
= 8600000 (Вт / м 2 )
= 8600 (кВт / м 2 )
Кондуктивная теплопередача через стенку емкости из нержавеющей стали толщиной 2 мм — разница температур 80 o C
Теплопроводность для нержавеющей стали 17 Вт / (м · К) (из таблицы выше).Кондуктивная теплопередача на единицу площади может быть рассчитана как
q / A = [(17 Вт / (м · K)) / (2 10 -3 м) ] (80 o C)
= 680000 (Вт / м 2 )
= 680 (кВт / м 2 )
.
* Большая часть от Янга, Хью Д., Университетская физика, 7-е изд.Таблица 15-5. Значения для аэрогеля алмаза и кремнезема из Справочника по химии и физике CRC. Обратите внимание, что 1 (кал / сек) / (см 2 C / см) = 419 Вт / м K. С учетом этого два приведенных выше столбца не всегда совпадают. Все значения взяты из опубликованных таблиц, но не могут считаться достоверными. Значение 0,02 Вт / мК для полиуретана может быть принято как номинальное значение, которое делает пенополиуретан одним из лучших изоляторов. NIST опубликовал программу численного приближения для расчета теплопроводности полиуретана на сайте http: // cryogenics.nist.gov/NewFiles/Polyurethane.html. Их расчет для полиуретана с фреоновым наполнением плотностью 1,99 фунт / фут 3 при 20 ° C дает теплопроводность 0,022 Вт / мК. Расчет для полиуретана с наполнителем CO 2 плотностью 2,00 фунт / фут 3 дает 0,035 Вт / мК. | Индекс Таблицы Ссылка |
Воздух — теплопроводность
Теплопроводность — это свойство материала, которое описывает способность проводить тепло . Теплопроводность может быть определена как
« количество тепла, передаваемого через единицу толщины материала в направлении, нормальном к поверхности единицы площади, из-за градиента единичной температуры в условиях устойчивого состояния».
Самыми распространенными единицами измерения теплопроводности являются Вт / (м · К) в системе СИ и БТЕ / (ч фут ° F) в британской системе мер.
Табличные значения и преобразование единиц теплопроводности приведены под рисунками.
Онлайн-калькулятор теплопроводности воздуха
Калькулятор, представленный ниже, можно использовать для расчета теплопроводности воздуха при заданных температуре и давлении.
Выходная проводимость выражается в мВт / (м · K), британских тепловых единицах (IT) / (ч фут · ° F) и ккал (IT) / (ч · м · K).
См. Также другие свойства Воздуха при изменяющейся температуре и давлении: Плотность и удельный вес при переменной температуре, Плотность при переменном давлении, Коэффициенты диффузии газов в воздухе, Число Прандтля, Удельная теплоемкость при различной температуре и Удельная теплоемкость при переменное давление, температуропроводность, свойства в условиях равновесия газ-жидкость и теплофизические свойства воздуха при стандартных условиях, а также состав и молекулярная масса,
, а также теплопроводность аммиака, бутана, диоксида углерода, этана, этилена, водорода, метана , азот, пропан и вода.
См. Также Калькулятор теплопроводности
Вернуться к началу
Вернуться к началу
Вернуться к началу
Теплопроводность воздуха при атмосферном давлении и температурах в ° C:
| Температура | Теплопроводность | ||||||||
| [° C] | [мВт / м K] | [ккал (IT) / (hm K)] | [BTU (IT) / (ч фут ° F)] | ||||||
| -190 | 7.82 | 0,00672 | 0,00452 | ||||||
| -150 | 11,69 | 0,01005 | 0,00675 | ||||||
| -100 | 16,20 | 0,01393 | 0,00936 | ||||||
| -75 | 18,34 | 0,01060 | |||||||
| -50 | 20,41 | 0,01755 | 0,01179 | ||||||
| -25 | 22,41 | 0.01927 | 0,01295 | ||||||
| -15 | 23,20 | 0,01995 | 0,01340 | ||||||
| -10 | 23,59 | 0,02028 | 0,01363 | ||||||
| -5 | 23,97 | 0,0201361 | |||||||
| 0 | 24,36 | 0,02094 | 0,01407 | ||||||
| 5 | 24,74 | 0,02127 | 0,01429 | ||||||
| 10 | 25.12 | 0,02160 | 0,01451 | ||||||
| 15 | 25,50 | 0,02192 | 0,01473 | ||||||
| 20 | 25,87 | 0,02225 | 0,01495 | ||||||
| 25 | 26,24 9007 | 0,02 | |||||||
| 30 | 26,62 | 0,02289 | 0,01538 | ||||||
| 40 | 27,35 | 0,02352 | 0.01580 | ||||||
| 50 | 28,08 | 0,02415 | 0,01623 | ||||||
| 60 | 28,80 | 0,02477 | 0,01664 | ||||||
| 80 | 30,23 | 0,02599 | 0,01746 | 10052 | 0,02548 | 0,01746 | 31,62 | 0,02719 | 0,01827 |
| 125 | 33,33 | 0,02866 | 0,01926 | ||||||
| 150 | 35.00 | 0,03010 | 0,02022 | ||||||
| 175 | 36,64 | 0,03151 | 0,02117 | ||||||
| 200 | 38,25 | 0,03289 | 0,02210 | ||||||
| 225 | 39,83 | 0,02 | |||||||
| 300 | 44,41 | 0,03819 | 0,02566 | ||||||
| 412 | 50,92 | 0,04378 | 0.02942 | ||||||
| 500 | 55,79 | 0,04797 | 0,03224 | ||||||
| 600 | 61,14 | 0,05257 | 0,03533 | ||||||
| 700 | 66,32 | 0,05702 | 0,03832 | 0,05702 | 0,03832 | 0,06135 | 0,04122 | ||
| 900 | 76,26 | 0,06557 | 0,04406 | ||||||
| 1000 | 81.08 | 0,06971 | 0,04685 | ||||||
| 1100 | 85,83 | 0,07380 | 0,04959 | ||||||
Наверх
Теплопроводность воздуха при атмосферном давлении и температурах в ° F:
| Температура | Теплопроводность | |||||
| [° F] | [британских тепловых единиц (IT) / (час футов ° F)] | [ккал (IT) / (hm K)] | [мВт / м · К] | |||
| -300 | 0.00484 | 0,00720 | 8,37 | |||
| -200 | 0,00788 | 0,01172 | 13,63 | |||
| -100 | 0,01068 | 0,01589 | 18,48 | |||
| -50 | 0,0170086 | 20,77 | ||||
| -20 | 0,01277 | 0,01901 | 22,10 | |||
| 0 | 0,01328 | 0.01976 | 22,98 | |||
| 10 | 0,01353 | 0,02013 | 23,41 | |||
| 20 | 0,01378 | 0,02050 | 23,84 | |||
| 30 | 0,01402 | 0,0208749 | ||||
| 0,01427 | 0,02123 | 24,70 | ||||
| 50 | 0,01451 | 0,02160 | 25,12 | |||
| 60 | 0.01476 | 0,02196 | 25,54 | |||
| 70 | 0,01500 | 0,02232 | 25,95 | |||
| 80 | 0,01524 | 0,02267 | 26,37 | |||
| 100 | 0,01571 33 | |||||
| 100 | 0,01571 | |||||
| 120 | 0,01618 | 0,02408 | 28,00 | |||
| 140 | 0,01664 | 0,02477 | 28.80 | |||
| 160 | 0,01710 | 0,02545 | 29,60 | |||
| 180 | 0,01755 | 0,02612 | 30,38 | |||
| 200 | 0,01800 | 0,02679 | 31,16 | 0,02679 | 31,16 | 0,01911 | 0,02843 | 33,07 |
| 300 | 0,02018 | 0,03003 | 34,93 | |||
| 350 | 0.02123 | 0,03160 | 36,75 | |||
| 400 | 0,02226 | 0,03313 | 38,53 | |||
| 450 | 0,02327 | 0,03463 | 40,28 | |||
| 500 | 0,02426 | |||||
| 500 | 0,02426 | |||||
| 600 | 0,02620 | 0,03898 | 45,34 | |||
| 700 | 0,02807 | 0.04177 | 48,58 | |||
| 800 | 0,02990 | 0,04449 | 51,74 | |||
| 1000 | 0,03342 | 0,04973 | 57,84 | |||
| 1200 | 0,03680 | 0,054,69 | 1400 | 0,04007 | 0,05963 | 69,35 |
| 1600 | 0,04325 | 0,06436 | 74.85 | |||
| 1800 | 0,04635 | 0,06898 | 80,23 | |||
| 2000 | 0,04941 | 0,07353 | 85,51 | |||
Преобразование единиц теплопроводности:
тепловая единица (международная) / (фут-час, градус Фаренгейта) [Btu (IT) / (ft h ° F], британская тепловая единица (международная) / (дюйм-час, градус Фаренгейта) [BTU (IT) / (в h ° F]) , британская тепловая единица (международная) * дюйм / (квадратный фут * час * градус Фаренгейта) [(британские тепловые единицы (IT) дюйм) / (фут² час ° F)], килокалория / (метр час градус Цельсия) [ккал / (mh ° C)], джоуль / (сантиметр второй градус кельвина) [Дж / (см · с · K)], ватт / (метр градус кельвина) [Вт / (м ° C)],
- 1 британская тепловая единица (IT) / (фут ч ° F) = 1/12 Btu (IT) / (в ч ° F) = 0.08333 британских тепловых единиц (IT) / (в ч ° F) = 12 Btu (IT) в / (фут 2 ч ° F) = 1,488 ккал / (мч ° C) = 0,01731 Дж / (см · с · K) = 1,731 Вт / (м · К)
- 1 британская тепловая единица (IT) / (в час · ° F) = 12 британских тепловых единиц (IT) / (фут · час · ° F) = 144 британских тепловых единицы (IT) · дюйм / (фут 2 час · ° F) = 17,858 ккал / (м · ч ° C) = 0,20769 Дж / (см · с · K) = 20,769 Вт / (м · K)
- 1 (британских тепловых единиц (IT) дюйм) / (фут² час ° F) = 0,08333 британских тепловых единиц (IT) / ( фут ч ° F) = 0,00694 британских тепловых единиц (IT) / (в час ° F) = 0,12401 ккал / (мч ° C) = 0,001442 Дж / (см · с · K) = 0,1442 Вт / (м · K)
- 1 Дж / ( см · с · K) = 100 Вт / (м · K) = 57,789 БТЕ (IT) / (фут · ч · ° F) = 4.8149 БТЕ (IT) / (в час ° F) = 693,35 (БТЕ (IT) дюйм) / (фут² час ° F) = 85,984 ккал / (мч ° C)
- 1 ккал / (мч ° C) = 0,6720 БТЕ (IT) / (фут · ч ° F) = 0,05600 Btu (IT) / (в час · ° F) = 8,0636 (Btu (IT) дюйм) / (фут 2 час · ° F) = 0,01163 Дж / (см · с · K ) = 1,163 Вт / (м · К)
- 1 Вт / (м · К) = 0,01 Дж / (см · с · К) = 0,5779 БТЕ (IT) / (фут · ч · ° F) = 0,04815 БТЕ (IT) / (дюйм · ч ° F) = 6,9335 (британских тепловых единиц (IT) дюйм) / (фут² ч ° F) = 0,85984 ккал / (мч ° C)
К началу
.